Mycobacterium tuberculosis
| Mycobacterium tuberculosis | |
 Bakteriekolonier av M. tuberculosis.
| |
| Systematik | |
|---|---|
| Domän |
Bakterier Bacteria |
| Stam | Actinobacteria |
| Ordning | Actinomycetales |
| Underordning | Corynebacterineae |
| Familj | Mycobacteriaceae |
| Släkte |
Mykobakterier Mycobacterium |
| Art | Mycobacterium tuberculosis complex |
| Vetenskapligt namn | |
| § Mycobacterium tuberculosis | |
| Auktor | (Zopf 1883) Lehmann & Neumann 1896 |
Mycobacterium tuberculosis är en orörlig, stavformad, aerob bakterie som är den främsta orsaken till tuberkulos hos människor. Något utmärkande för M. tuberculosis-bakterien och andra mykobakterier är den långsamma delningstakten. Bakterien delar sig var 16–25 timme, vilket kan jämföras med E. colis snabba generationstid på 20 minuter. Den långa generationstiden kan ge effekter i form av svårigheter med diagnostisering och behandling eftersom bakterien generellt är ganska tålig mot viss antibiotika. Det är viktigt att studera genetik och fysiologi hos M. tuberculosis och närbesläktade mykobakterier för att kunna utveckla nya läkemedel, vilket i sin tur är viktigt för att kunna bekämpa bakterien eftersom virulensen och resistens mellan de olika stammarna varierar. Det är också viktigt att förstå hur M. tuberculosis interagerar med den värd den infekterar för att lära sig hur bakterierna kringgår värdförsvar, orsakar sjukdom och utvecklar resistens.M. tuberculosis ingår i ett kluster med gemensamt fylogenetiskt släktskap – Mycobacterium tuberculosis-komplexet (MTBC) – som har utvecklats tillsammans med människan.
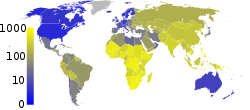
M. tuberculosis återfinns i hela världen men är något vanligare i Afrika och Asien. Ungefär en tredjedel av jordens befolkning tros vara bärare av bakterien, men det är endast cirka 5-10 procent av dem som har blivit smittade av M. tuberculosis som utvecklar sjukdomen tuberkulos. Cirka 10 miljoner människor utvecklar aktiv tuberkulos och cirka 1,7 miljoner människor dör av sjukdomen varje år. I Sverige är infektioner med M. tuberculosis begränsade för svenskfödda, och fallen består till största delen av personer födda utomlands.
Innehåll
Genom
Genetiken hos M. tuberculosis var länge ett förbisett ämne på grund av att det fanns arbetsmässiga svårigheter med organismen samt brist på lämpliga verktyg. Anledningen till att det har varit svårt att utveckla genetiska verktyg för bakterien är dess låga omvandlingseffektivitet och homologa rekombination samt att den naturligt är långsamt växande.
M. tuberculosis H37Rv är den mest studerade stammen i tuberkulosforskning. H37Rv-stammens genom publicerades för första gången 1998.Genomet omfattade då drygt 4,4 miljoner baspar och innehöll totalt 3974 gener, varav 3924 gener kodar för proteiner och 50 gener kodar för funktionella RNA-molekyler. Genomet innehåller också sex pseudogener. Efter en uppdatering 2002 inkluderades ytterligare 82 gener. Samtliga nya gener som upptäcktes tros koda för proteiner, och angående de gener som kodar för RNA kunde inga förändringar detekteras. Det innebär att man idag känner till totalt 4056 gener. Cirka 40 procent av proteinerna kunde knytas till exakta funktioner och utöver det fanns ytterligare 44 procent proteiner med viss information eller likhet med de proteinerna med exakta funktioner. De återstående 16 procent proteiner liknade inga kända proteiner men kan innehålla specifika mykobakteriella funktioner som inte är kända.
M. tuberculosis genomsekvens påvisar att bakterien kan syntetisera alla väsentliga aminosyror, vitaminer och enzymer den behöver. Dess metabola vägar kan skilja sig från andra bakterier men bakterien kan metabolisera en mängd olika kolhydrater, kolväten, alkoholer, ketoner och karboxylsyror. Under aeroba tillväxtförhållanden kan M. tuberculosis producera ATP genom oxidativ fosforylering från elektrontransportkedjor. Bakterien har även två gener som kodar för hemoglobinliknande proteiner vilka kan skydda mot oxidativ stress eller vara involverade i syreupptagning. Det bidrar till att bakterien kan anpassa sin metabolism till miljöförändring vilket har stor betydelsefull för dess överlevnad.
Sekvensen av de cirka 4,4 miljoner baspar innebär att M. tuberculosis är den näst största bakteriella genomsekvensen som för närvarande är tillgänglig och av de ingående nukleotiderna står Guanin (G) och Cytosin (C) för 65,6 procent av innehållet. Genomet innehåller en stor mängd repetitivt DNA och andelen av G + C är relativt konstant genom genomet vilket indikerar att virulensgenerna troligtvis inte är samlade i patogenitetsöar (specifika regioner i de prokaryota genomet som kodar för abstrakta virulensfaktorer för patogena bakterier) som kan flyttas mellan bakterier. Flera områden som uppvisade högre G + C-innehåll än genomsnittligt motsvarar sekvenser som tillhör en stor genfamilj som inkluderar de polymorfa G + C-rika sekvenserna, vilket då kan bidra till varianter inom arten.
Livscykel

M. tuberculosis smittas då den som är smittad har aktiv tuberkulos i lungorna och hostar, och det förs över från person till en ny person genom inandning av aerosola droppar som finns i hostningen. Härifrån börjar den intracellulära livscykeln.
Första infektionen
Infektionen börjar med att M. tuberculosis kommer in i lungorna och immunförsvaret i lungorna börjar fagocytera M. tuberculosis med hjälp av makrofager i alveolerna. Det leder till en inflammation i vävnaden och detta bildar granulom. När patienten blivit infekterad så blir M. tuberculosis vanligen till latent, LMTB, men kan även bli aktiv M. tuberculosis, beroende på patientens immunförsvar. Det är makrofager, dendritiska celler och lymfocyter från nära blodkärl som aktiveras och formar granulomen och är ett kännetecken för bakterien.
Intracellulär
Vid granulom formning antingen avstannar M. tuberculosis och sprids inte vidare och granulomen blir till en skorpa (ghons complex) eller att M. tuberculosis återaktiveras och sprids vidare. Att bakterien fagocyteras av makrofagen är vital för dess överlevnad inom människan. Det är där den får sin ATP och lipider ifrån som behövs för att den ska replikera sig själv.
Lipiderna används främst som en källa för näring såsom kol, under dess latenta stadium. Lipiderna är även viktiga då de krävs för att den ska kunna återaktivera sig. Utöver att få tag på lipiderna från makrofagen, får den även tag på lipider som är restprodukt från nedbrytning av immunceller.
När en makrofag har fagocyterat bakterien så särskiljer de sig, där de antingen kan bli epiteloidcell då den bildar en vakuol runtom bakterien och förhindrar spridning eller blir det en skumcell. Vilken typ av makrofag som finns in situ påverkar bakteriens överlevnad.
Om makrofagen blir en skumcell så bildar den lipider inom det inflammerade området. Lipiderna tas upp genom enzymer som är specialiserade på lipider eller aktivering av patientens egna hydrolys enzymer. Det visar på att M. tuberculosis kan ändra fysiologiska egenskaper inom granulomen, där varje granulom agerar självständigt, som ger en förklaring huruvida M. tuberculosis är aktiv eller inte inom en granulom.
Överlevnad under livscykeln
M. tuberculosis kan ändra sin process av maturation. Det vill säga att under icke gynnsamma förhållanden kan bakterien gå in i latent stadium och sedan återaktivera sig själv då stressfaktorerna som fanns är borta. Bakterien känner av olika stressfaktorer via regulerande proteiner, där 11 av dessa påverkar den intracellulära miljön. De flesta M. tuberculosis kan producera ROS, som påverkar värdens immunförsvar, vilket leder till att bakterien inte utsätts för eliminering. Om M. tuberculosis kommer förbi detta så blir den antingen aktiv M. tuberculosis eller latent M. tuberculosis, vilket då innebär att bakterien är situationsadapterad i dess livscykel.
En viktig anledning till att M. tuberculosis blir latent M. tuberculosis, är syrebrist (hypoxi) i granulomen. Det ger en re-modellering och nedbrytning av bakteriens cellvägg och dess metabolism blir långsammare. Under den tiden blir M. tuberculosis mestadels resistent mot penicillin och steptomycin. Trots att bakterien har utvecklat olika medel för att överleva inom en makrofag så kan bakterien även dö inom den. Det kan ske genom kväveoxid, för lågt pH eller autofagocytos.
M. tuberculosis överlever detta genom att den fagocyteras in i makrofagen till cytosolen, vilket leder till celldöd av makrofagen. När makrofagen dör så kan bakterierna som varit inom den och replikerats, sprida sig. För att kunna replikeras inom makrofagen så stimulerar bakterien produktionen av kolestrol och lipider, makrofagen som bildar det mest effektivt är skumcellen, och för att se till dess överlevnad, vid fagocytos av M. tuberculosis så har den en lipid på dess cellvägg som heter trehalosdimykolat (TDM) som gör att makrofagen bildar fler skumceller än epiteloidceller. För att apoptos inte ska ske av makrofagen som är infekterad, så utsöndrar M. tuberculosis ett protein som förhindrar det. Det resulterar i att bakterien kan vara latent under en längre tid, ända upp till decennier.M. tuberculosis påverkar även cytokiner som minskar T-celler in situ eller som gör att makrofagen går igenom nekros istället för apoptos, där makrofagen som genomgår den typen av celldöd är mer gynnsamt för bakterien. Detta beror på att nekros inte har någon nedbrytning av makrofagen och därav inte har negativ påverkan på M. tuberculosis som residerar inom den.
Sista delen av dess cellcykel är då den sprids vidare till en annan person. Det är när en latent M. tuberculosis åter blir aktiverad. Det sker genom ett sekretorisk protein som bara produceras när stressfaktorerna inte längre finns. Det här proteinet är viktigt för hydrolys av cellväggen, som i sin tur är viktigt för första steget i reaktivering av M. tuberculosis. Genom hydrolys förstörs cellväggen av granulomen och tillväxt av bakterien ökar för att dess omgivning går från syrefattigt till syrerikt, så den återupptar sin respiration. Vad som kan leda till stressminskning är exempelvis ett försvagat immunförsvar. När bakterien lämnar granulomen så är den även smittsam, det sker dock bara om granulomen befinner sig i lungorna, men den kan även sprida sig inom sin värd under den tiden, genom att M. tuberculosis hamnar i blodet och fagocyteras av makrofager i en annan del av kroppen.
Replikation
Vanligen sker celldelning när cellen når en viss storlek, och så delas den. Men för M. tuberculosis så sker detta oberoende av tiden, det vill säga att M. tuberculosis som förlänger sin DNA-sträng snabbt delar sig inte mer frekvent än de som förlänger sin DNA-sträng långsamt. Detta är en viktig orsak till att bakterien är olika mottagliga mot antibiotika. Det kallas även för unipolär tillväxt, där ena dottercellen ärver tillväxthastigheten och den andra skapar sin egen tillväxthastighet. Den som ärver tillväxthastigheten har i genomsnitt snabbare cell delning och är oftast längre vid replikering, replikationen tar runt 22 timmar.
Cellvägg
Cellväggen består av fyra områden, plasmamembran, arabinogalactan, peptidoglykan och mycomembran samt kapsel som omsluter detta.
Mycomembranets främsta uppgift är att flytta cellväggs lipider samt molekyler över plasmamembranet. Det finns även ett protein, MmpL (mycobacterium membrane protein large), som ökar metabolismen av fettsyror i värden. Mycomembranet har även koll på sin egen metabolism och ändrar cellväggen i respons på hur omgivningen ser ut. Utöver detta så består den av mykolsyror.
Proteinerna på plasmamembranet tillhör efflux superfamiljen RND (resistance-nodulation-cell-division) som är pumpar som leder till homeostasis inom M. tuberculosis. Pumparna påverkar indirekt spridning av bakterien då den transporterar ut substrat som påverkar negativt dess överlevnad.
Peptidoglykan är rik på lipider, detta gör att hydrofobisk antibiotika kan diffundera in i cellen men Hydrofil antibiotika inte kan göra det. Dessa lipider är även viktiga för att interagera med olika receptorer på makrofagen och dendritiska celler. De orsakar exempelvis apoptos av makrofagen eller ökar produktion av dendritiska celler. På peptidoglykan finns det även poriner som är till för hydrofiliska ämnen, poriner har dock låg upptagningsnivå. Överlag gör peptidoglykan M. tuberculosis till en osmotisk stadig bakterie.
Strukturordningen på cellväggen är att först är det peptidoglykan, på den sitter arabinogalactan fast som ett nät, på arabinoglycan fästs mykolsyror och fettsyror.
Evolution
M. tuberculosis ingår i ett kluster med gemensamt fylogenetiskt släktskap, Mycobacterium tuberculosis complex (MTBC). Mycobacterium tuberculosis complex innefattar arter som kan orsaka tuberkulos hos människor och djur såsom M. africanum, M. canettii, M. microti, M. pinnipedi, M. caprae och M. bovis. Av dessa är M. tuberculosis och M. africanum anpassade till människan.
M. canettii är det troliga ursprunget för de olika bakterierna inom MTBC. M. canetti är geografiskt begränsad till Afrikas horn där arterna inom MTBC tros ha sitt ursprung.
Fylogenetiska studier visar hur de olika arterna inom M. tuberculosis complex har evolverat. De fylogenetiska studierna visar att det finns en fylogeografisk struktur som innefattar sju olika linjer med fylogenetiskt släktskap för människoanpassad MTBC (M. tuberculosis och M. africanum). Linje 1, 2, 3, 4 och 7 står för M. tuberculosis geografiska utbredning, medan linje 5 och 6 visar M. africanums geografiska placering. Linje 1 omfattar Östafrika, Filippinerna och Indiska Oceanen, linje 2 återfinns i Östasien, linje 3 innefattar Östafrika och Centralasien, linje 4 omfattar Europa, Amerika och Afrika och linje 7 återfinns i Etiopien. För M. africanum är båda linjerna geografiskt samlade till Västafrika.
Vidare delas de sju linjerna inom MTBC in i två större kluster där en åtskillnad görs mellan evolutionärt modern MTBC och en evolutionärt äldre MTBC. Evolutionärt modern MTBC har en frånvaro av TbD1 (ett locus som innehåller två gener) som återfinns i äldre MTBC. Frånvaron av TbD1 skiljer därmed linje 2, 3 och 4 från linje 1 och 7 där linje 2, 3 och 4 är en modern form av MTBC som bildar en egen monofyletisk grupp. Linje 2 och 4 är mest utbredda i världen och står för flest fall av tuberkulos.
Samevolution med människan
Det finns två huvudsakliga belägg som stödjer att MTBC har samevolverat med människan. Den första är de kopplingar som finns mellan människors mitokondriella DNA och vilken linje av MTBC som en individ blir påverkad av. Att individens ursprung är av betydelse tyder på att de olika linjerna har anpassats till olika områden med människor med ett gemensamt genetiskt ursprung (haplogrupp).
Det andra belägget för M. tuberculosis samevolution med människan är att bakterien kan vara latent samtidigt som den kan vara mycket virulent. Dessa egenskaper tyder på att M. tuberculosis har anpassat sig till både glest bebyggda områden liksom tätt befolkade områden. Den ökade virulensen i modern MTBC kan förklaras med att människan med början i den yngre stenålden har börjat bo allt tätare. Jordbrukets inträde föranledde än tätare bebyggelse och så småningom skedde en urbanisering i samband med den industriella revolutionen. Samtidigt som vi bor allt tätare har även jordens befolkning ökat.
Ytterligare ett belägg för hypotesen att MTBC har samevolverat med människan är att Afrika är den region där samtliga linjer av MTBC finns representerade. En hypotes är att de olika linjerna av MTBC har börjat spridas från Afrika när människan utvandrade från Afrika till andra delar av världen.
Det finns olika teorier om åldern på M. tuberculosis. Molekylär klocka användes av Wirth et.al. för att datera bakteriens ålder vilket gav ett ursprung på 40 000 år tillbaka i tiden. En annan metod som används för att fastställa åldern har studerat kopplingen mellan linje av MTBC och haplogrupper. Comas et. al. kom med denna metod kom fram till att åldern på MTBC är mellan 50 000 – 96000 år gammal. Ytterligare en studie av Pepperell et.al. som studerade kopplingen mellan Y-kromosomer och genomet hos MTBC daterade de olika linjernas ålder till mellan 830 och 3142 år gamla. En studie där 1000 år gamla mumiers DNA undersöktes kom fram till liknande resultat. Det finns dock fynd från skelett som tyder på att MTBC är äldre än så.
Förekomst
M. tuberculosis-bakterien återfinns över hela världen och cirka en tredjedel av jordens befolkning beräknas vara bärare av bakterien. Av dessa utvecklar ungefär 10 miljoner människor årligen aktiv tuberkulos och cirka 1,7 miljoner människor dör av sjukdomen varje år, vilket är ungefär 5000 varje dag. Det är främst personer i Afrika och Asien och med nedsatt immunförsvar som dör av sjukdomen.
Bakterien smittar via luften när någon som är tuberkulossjuk nyser eller hostar. De små infekterade dropparna kan leva i luften länge och det behövs väldigt få bakterier för att bli smittad. Dock är det endast 5-10 procent av dem som har blivit smittade av M. tuberculosis bakterien som utvecklar tuberkulos.
Bakterien kan också spridas via livsmedel, exempelvis om ett djur är bärare av tuberkulos följer bakterierna med i opastöriserad mjölk eller ost.
Från att man blir smittad kan det dröja från några månader upp till flera år innan sjukdomen bryter ut. M. tuberculosis är den bakterie som dödar flest antal människor per år. Om man är bärare av hiv och samtidigt blir smittad av M. tuberculosis bakterien så kan sjukdomen tuberkulos bryta ut snabbare genom att kroppens immunförsvar redan är försämrat och då inte kan kapsla in bakterierna. WHO vill stoppa tuberkulos och M. tuberculosis bakterien helt och har satt upp mål tillsammans med FN att M. tuberculosis epidemin ska vara stoppad tills år 2030.
Symtom
M. tuberculosis bakterien orsakar främst infektionssjukdomen tuberkulos, TBC eller lungsot som sjukdomen kallades för förr.
Bakterien kan även orsaka hjärnhinneinflammation och miliartuberkulos, det vill säga tuberkulos i blodet. Sjukdomen tuberkulos drabbar främst lungorna men kan även sätta sig på andra ställen i kroppen som urinvägar, hjärna, mage, skelettet och lymfkörtlar. I Sverige är den vanligaste tuberkulos formen lungtuberkulos.
Lungtuberkolos kan vara aktiv eller latent. Aktiv lungtuberkulos betyder att man är sjuk och har symtom som exempelvis hosta, och innebär även att man för smittan vidare när man nyser eller hostar.Latent lungtuberkulos innebär att personen till synes är frisk och bakterietillväxten hålls under kontroll genom att den som är smittad har ett så pass bra immunförsvar i kroppen så att det inte kan bildas några hålrum för bakteriehärdar att växa i och tuberkelbakterierna kapslas in i. Detta innebär också att personen inte smittar så länge lungtuberkulosen är latent. Men vid försämrat immunförsvar eller vid hög ålder så kan den latenta lungtuberkulosen förändras och istället bli aktiv lungtuberkulos.
Behandling
Läkemedel har en långsam påverkan på M. tuberculosis vilket bland annat beror på att den är långsamt växande. Behandling sker med flera läkemedel samtidigt som påverkar bakterien på olika sätt för att undvika att den utvecklar motståndskraft eller resistens. Oavsett vilket organ som angripits är behandlingen densamma med en generell behandlingstid på 6 månader, undantag är M. tuberculosis i hjärnhinnorna som kräver högre doser och längre behandlingstid. Under de första månaderna genomförs behandlingen med fyra olika läkemedel. De viktigaste läkemedlen vid behandling innehåller ämnena rifampicin och isoniazid, vilka har en starkt bakteriehämmande effekt. De övriga två läkemedlen innehåller pyrazinamid och etambutol och de minskar främst motståndskraften hos bakterierna.
Vaccin
I Sverige genomförs inte vaccination rutinmässigt mot tuberkulos och har inte gjort sedan mitten på 1970-talet. Däremot erbjuds vaccination till barn i vissa riskgrupper och där ingår barn med familjeursprung från ett land med M. tuberculosis-förekomst (ökad, hög eller särskilt hög), barn med aktiv M. tuberculosis hos en nära anhörig eller inför planerad längre vistelse i (mer än tre månader) ett land med hög M. tuberculosis-förekomst. Vaccinet Bacillus Calmette-Guérin (BCG) skyddar inte mot lungtuberkulos hos vuxen.
Läkemedelsresistens
Behandlingen mot M. tuberculosis är svår då bakterien naturligt har en resistens mot en mängd antibiotika. Resistensen beror huvudsakligen på det hydrofoba cellhöljet som verkar som en permeabilitetsbarriär men genomet kodar också för många potentiella resistansdeterminanter. Dessa innefattar förstörande hydrolytiska eller läkemedelsmodifierande enzymer. Kunskap om motståndsmekanismerna främjar en bättre behandling och underlättar bättre användning av befintliga läkemedel.
Behandlingen blir mer komplicerad när bakterierna är resistenta och det finns en multiresistent bakterie som är resistent mot både isoniazid och rifampicin vilket ur behandlingshänseende blir mycket problematiskt på grund av att behandlingsalternativen inte är lite effektiva. Behandlingstiden vid multiresistent TBC är längre, cirka 2 år.
|